Tuberculose : tirer parti du «suicide» du bacille
La bactérie responsable de la tuberculose produit une toxine mortelle pour elle à moins d’être neutralisée par une protéine antidote. C’est la découverte d’une équipe européenne co-coordonnée par des chercheurs de l'Institut de pharmacologie et de biologie structurale (IPBS, CNRS/UT3 – Paul Sabatier) et de l’EMBL1 , publiée dans la revue Molecular Cell le 18 février 2019. Les scientifiques cherchent à présent à détourner ce mécanisme de « suicide » à des fins thérapeutiques.
- 1Equipe coordonnée conjointement par des chercheurs de l'Institut de pharmacologie et de biologie structurale (CNRS/UT3 – Paul Sabatier) et de l’EMBL (Hambourg, Allemagne), incluant également des chercheurs du Francis Crick Institute (Royaume-Uni) et du Laboratoire de microbiologie et génétique moléculaires (CNRS/UT3 – Paul Sabatier) du Centre de biologie intégrative de Toulouse (CNRS/UT3 Paul Sabatier).
Les bactéries produisent des molécules toxiques pour elles-mêmes, qui sont activées lorsque l’environnement devient défavorable : elles ralentissent alors la croissance de la population bactérienne en attendant le retour de conditions plus clémentes. Certaines de ces toxines vont jusqu’à tuer les bactéries qui les produisent. La signification d’un tel « suicide » reste débattue : il pourrait servir de défense antivirale en éliminant les bactéries infectées pour épargner leurs voisines, ou permettre, en condition de carence nutritionnelle, le « sacrifice » d’une partie des bactéries au profit du reste de la population. En conditions normales, les bactéries produisent des protéines antidotes qui neutralisent l’effet de ces toxines.
L'équipe de chercheurs vient d'identifier une telle toxine de « suicide », appelée MbcT, chez le bacille de la tuberculose, Mycobacterium tuberculosis. Lorsqu’elle n’est pas neutralisée par son antitoxine MbcA, MbcT tue la bactérie en dégradant son contenu en NAD, une petite molécule nécessaire à la vie, selon une réaction qui n’avait encore jamais été mise en évidence.
En outre, l’équipe d’Olivier Neyrolles, chercheur CNRS à l’IPBS, a montré l’intérêt thérapeutique de cette toxine. Les chercheurs ont infecté des cellules humaines et des souris avec une souche de tuberculose dépourvue de ce système toxine-antitoxine, mais chez laquelle ils pouvaient déclencher artificiellement la production de la toxine MbcT. L’activation de la toxine a drastiquement diminué le nombre de bactéries infectant les cellules et a augmenté la survie des souris.
Ces résultats ouvrent donc une piste de traitement totalement inédite pour combattre la tuberculose, qui reste l’une des 10 premières causes de décès au monde. Un enjeu d’autant plus important face aux résistances aux antibiotiques développées par certaines souches de Mycobacterium tuberculosis. Les chercheurs de l’EMBL ayant déterminé la structure 3D du complexe MbcT-MbcA, les différentes équipes travaillent à présent à l’identification de composés capables de libérer la toxine de son antidote. Ces molécules pourraient être utiles pour combattre d’autres infections puisque des systèmes analogues ont été identifiés chez d’autres bactéries pathogènes.
Ces travaux ont été financés, entre autres, par l'Agence nationale de la recherche (ANR), la Fondation pour la recherche médicale (FRM) et la Fondation Bettencourt-Schueller.
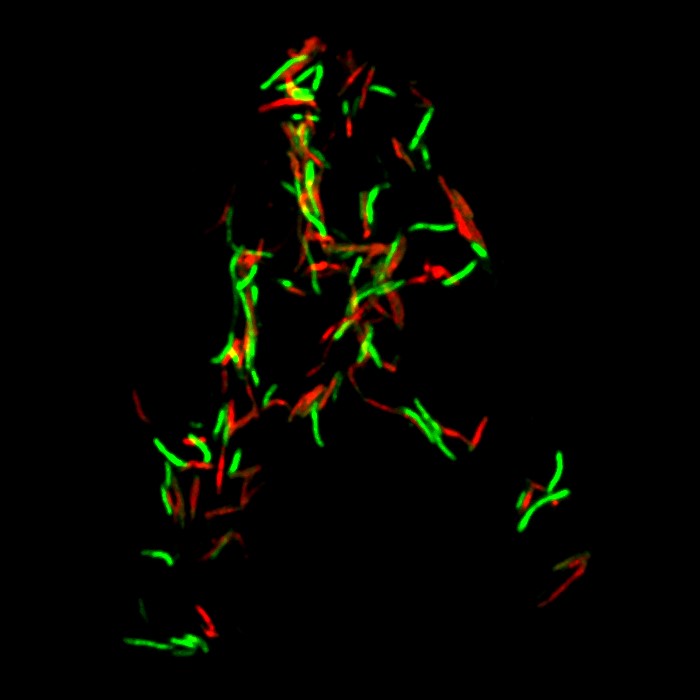
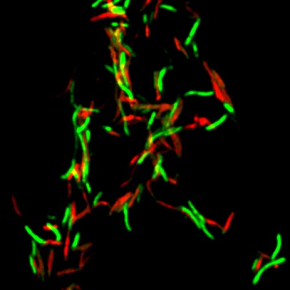
Lorsque la toxine MbcT est produite sans son antidote, elle induit la mort des bactéries (marquées en rouge).
© Antonio Peixoto, Claude Gutierrez et Olivier Neyrolles / IPBS / CNRS-UT3 – Paul Sabatier
An NAD+ phosphorylase toxin triggers Mycobacterium tuberculosis cell death, Diana Mendes Freire*, Claude Gutierrez*, Acely Garza-Garcia, Anna D. Grabowska, Ambre J. Sala, Kanchiyaphat Ariyachaokun, Terezie Panikova, Katherine S.H. Beckham, André Colom, Vivian Pogenberg, Michele Cianci, Anne Tuukkanen, Yves-Marie Boudehen, Antonio Peixoto, Laure Botella, Dmitri I. Svergun, Dirk Schnappinger, Thomas R. Schneider, Pierre Genevaux, Luiz Pedro S. de Carvalho, Matthias Wilmanns, Annabel H.A. Parret** and Olivier Neyrolles**. Molecular Cell, 18 février 2019.