Remise en cause d’un dogme en biologie de la reproduction
La méiose est un aspect essentiel de la reproduction sexuée. Il était admis depuis presque 15 ans que l’acide rétinoïque, une molécule synthétisée à partir de la vitamine A, induisait l’entrée en méiose des cellules germinales chez les mammifères. Dans deux articles conjoints publiés le 22 mai 2020 dans la revue Science Advances, des chercheurs de l’Institut de biologie Valrose (CNRS/Inserm/Université Côte d’Azur) et de l’IGBMC (CNRS/Inserm/Université de Strasbourg) ont démontré, chez la souris, que la méiose démarre et se déroule normalement en absence d’acide rétinoïque, ouvrant ainsi de nouvelles perspectives de recherches en biologie de la reproduction.
La méiose est un processus essentiel qui permet le brassage des chromosomes et la transmission d’une information génétique unique à la descendance. À partir d'une cellule germinale diploïde1 (ovogonie chez la femelle, spermatogonie chez le mâle), la méiose produit des gamètes haploïdes2 (ovocyte chez la femelle, spermatozoïde chez le mâle). La rencontre d’un ovocyte et d’un spermatozoïde unit deux génomes parentaux pour reformer une cellule diploïde, à l’origine du futur embryon, ce qui marque le commencement de la génération suivante.
Chez les mammifères, les cellules présentes dans les gonades en développement (ovaire chez la femelle, testicule chez le mâle) fournissent un soutien architectural, nourricier et protecteur aux cellules germinales. Elles émettent aussi des signaux moléculaires qui instruisent le destin des cellules germinales. Parmi ces signaux, on trouve l’acide rétinoïque, qui permettrait de stimuler l’entrée des cellules germinales en méiose. Une étude publiée en 2011 a cependant jeté le doute quant à ce rôle de l’acide rétinoïque. Malgré cela, au fil du temps, l’idée que l’acide rétinoïque est la molécule qui instruit le déclenchement de la méiose a été érigée au rang de dogme.
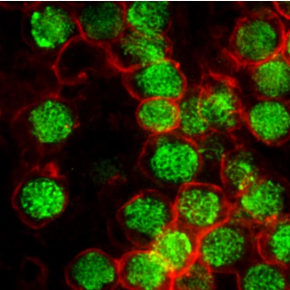
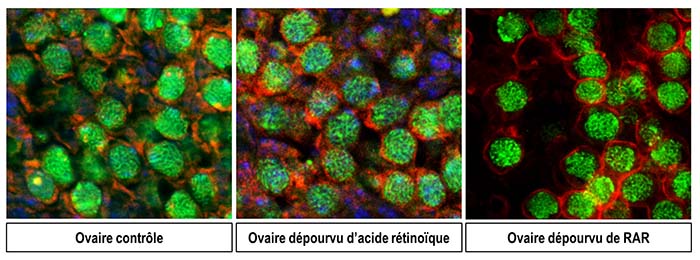
Pour clarifier le rôle de l’acide rétinoïque, des scientifiques niçois et strasbourgeois3 ont utilisé deux approches complémentaires. Dans la première, ils ont empêché la fabrication d’acide rétinoïque dans l’ovaire embryonnaire de souris. Dans la seconde, ils ont bloqué le message relayé par l’acide rétinoïque en invalidant ses récepteurs. Dans les deux cas, les cellules germinales initient la méiose normalement. Mieux encore, les ovocytes dépourvus de récepteurs de l’acide rétinoïque donnent naissance, après fécondation, à des souriceaux viables, preuve que leur fonctionnalité n’est pas altérée.
Ces deux études réfutent donc l’idée que l’acide rétinoïque joue le rôle d’initiateur de l’entrée en méiose des cellules germinales. Elles battent en brèche le dogme établi et résolvent un contentieux vieux de presque 15 ans. En levant un verrou conceptuel, la découverte de ces scientifiques conduira la communauté scientifique à reconsidérer ses hypothèses de travail. Elle suscitera de nouvelles pistes, à la recherche des véritables signaux qui contrôlent l’entrée en méiose des cellules germinales.
- 1Une cellule diploïde comporte une paire de chromosomes homologues.
- 2Une cellule haploïde comporte un seul exemple de chaque chromosome.
- 3Ces travaux impliquent également des chercheurs et chercheuses du Service de biologie de la reproduction des Hôpitaux universitaires de Strasbourg, du laboratoire Biologie de la reproduction, environnement, épigénétique, et développement (Inrae/Université Paris Saclay/Enva) et des scientifiques de l’université de Genève et du German Cancer Research Center.
Retinoic Acid synthesis by ALDH1A proteins is dispensable for meiosis initiation in the mouse fetal ovary. Anne Amandine Chassot, Morgane Le Rolle, Geneviève Jolivet, Isabelle Stevant, Jean-Marie Guigonis Fabio Da Silva, Serge Nef, Eric Pailhoux, Andreas Schedl, Norbert B. Ghyselinck et Marie-Christine Chaboissier. Science Advances, 22 mai 2020. DOI : 10.1126/sciadv.aaz1261
Meiosis occurs normally in the fetal ovary of mice lacking all retinoic acid receptors. Nadège Vernet, Diana Condrea, Chloé Mayere, Betty Féret, Muriel Klopfenstein, William Magnant, Violaine Alunni, Marius Teletin, Sirine Souali-Crespo, Serge Nef, Manuel Mark, et Norbert B. Ghyselinck. Science Advances, 22 mai 2020. DOI : 10.1126/sciadv.aaz1139.